บันทึกหลังคาบเรียน เทอม2/2553 Organic Chemistry
คาบเรียนที่ 1 วันศุกร์ ที่ 29 ต.ค. 2553 "เปิดบทละคร เรื่อง เคมีอินทรีย์"
เรื่องย่อ : วิชาที่ว่าด้วยสารประกอบของ C อยู่ในธรรมชาติ เป็นองค์ประกอบของ สมชว.
ผู้แต่ง (บิดา Or Chem): เฟรดริค วอเลอร์ (Frieddrick Wohler) *จำนะจ๊ะ
ผลงาน ชิ้นสำคัญ ของผู้แต่ง: สังเคราะห์ Urea(อินทรีย์) ได้จาก Ammonium cyanate(อนินทรีย์) เมื่อปี 1828
พระเอกของเรื่อง : Carbon (C)
พระรอง(เบ๊พระเอก) : Hydrogen (H)
ตัวประกอบ : O,N,S,P,F,Cl,Br,I
เกี่ยวกับละคร : มี 3 ตอน
ตอนที่1 เฉพาะอะตอมของ C และ H
ตอนที่2 C ที่มีหมู่ฟังก์ัชัน
ตอนที่3 สารชีวโมเลกุล
รู้จักกับพระเอก :
Carbon (C)
-เกาะ(สร้างพันธะ) กับธาตุอื่นได้ 4 พันธะ
-เกาะกันเอง ได้ 3 พันธะ
-ต่อกันเป็นโซ่ยาวๆ(โซ่เปิด) เรียก Chain
-ต่อกันเป็นวง(โซ่ปิด) เรียก Ring
-ต่อกันยาวๆแล้วมีกิ่งก้านสาขาออกจากโซ่หลัก เรียก Branch
-มีการจัดเรียงแบ บ 1s2 2s2 2p2
การเกิดพันธะ : เกิดจากความอยากเสถียร(พลังงานต่ำๆ)ของธาตุหมู่ต่างๆ (ยกเว้นหมู่ 8)
การเกิด Hybridization : การจัดเรียงของ e-
มี 3 แบบ
1.แบบ sp3 (Alkanes)
เป็นการรวมออร์บิทอล จาก 2s 1 ออร์บิทอล และ 2px 2py 2pz เรียก ทั้ง4 ออร์บิทอลที่สร้างพันธะเดี่ยวว่า พันธะซิกมาและเรียก e- ที่มาสร้างพันธะ่ว่า อิลเ็ลตรอนซิกมา
ตัวอย่าง Methane ( CH4
 | |
| โครงสร้างแบบ |
Single Bond = 1 ซิกมา
2.แบบ sp2 (Alkenes)
เป็นการรวมออร์บิทอล จาก 2s 1 ออร์บิทอล และ 2px 2py จำนวน 2 ออร์บิทอล เป็น 3 ออร์บิทอล อยู่ในระดับพลังงานเดียวกัน ส่วน 2pz ไว้สร้างพันธะที่เรียกว่า พันธะไพ และ e-
ตัวอย่าง Ethene ( C2H4
 |
| โครงสร้างแบบ sp2 มี Double Bond |
Double Bond = 1 ซิกมา 1 ไพ
 |
| โครงสร้างแบบ sp มี Triple Bond |
Triple Bond = 1 ซิกมา 2 ไพ
สรุปเล็กๆ
- พันธะซิกมา
ของ C-H สั้นและแข็งแรงกว่า C-C
- จำนวนพันธะมาก
ความแข็งแรงมาก แต่ความยาวจะน้อย
- พันธะไพ
อ่อนแอกว่าพันธะซิกมา
ทบทวนแรงระหว่างโมเลกุลจ้าา
1. แวนเดอร์วาลส์
แบบลอนดอน (แรงของโคเวเลนต์ไม่มีขั้ว)
2. ไดโพล-ไดโพล (แรงของโคเวเลนต์มีขั้ว)
3. พันธะไฮโดรเจน
(แรงระหว่าง H กับ
F,O,N )
การเขียนสูตรโครงสร้างของสารอินทรีย์ (ต.ย. หน้า 7) มี
4 แบบ ได้แก่
1.สูตรโมเลกุล-บอกว่าประกอบด้วยธาตุอะไร? อย่างละเท่าไหร่?
2.สูตรแบบจุด-แสดงการจับกันว่า
ธาตุตัวไหนจับกับตัวไหน? กี่แขน? ยังไง?
3.สูตรแบบย่อ-เขียนแบบย่อๆติดกันเป็นแถบ
คาบเรียนที่ 2
วันอังคาร ที่ 2 พ.ย. 2553
"Properties-Isomerism-Classification-Reaction-Bond Forming and cleavage"
สมบัติทางกายภาพกับสูตรงโครงสร้าง
1.Melting-Boiling
Point
เป็นการกระทำกันภายในตัวเอง(สารอื่นอย่ามายุ่ง)
พลังงานที่เข้าไปจะไปทำลาย แรงยึดระหว่างโมเลกุลเท่านั้น
ไม่ได้ทำให้พันธะหรือแรงยึดภายในโมเลกุลแตกออก
เป็นผลให้สารนั้นยังตงเป็นสารเดิมเปลี่ยนเพียงแค่สถานะเท่านั้น
2.Solubility
การละลายเกิดจาสภาพขั้วเหมือนกัน
สรุปได้
1.ไม่มีขั้วละลายกับไม่มีขั้ว
2.มีขั้วละลายกับมีขั้ว
3.ถ้ามีขั้วละลายแล้วเกิดพันธะH ถือว่า ละลายได้ดีมาก
Isomerism
1. Structural Isomer
- สูตรโมเลกุลเหมือน สูตรโครงสร้างต่าง แบ่งเป็น
-
Skeleton
isomer
-
Positional isomer
-
Functional isomer
2. Stereo Isomer
- สูตรโมเลกุลเหมือน สูตรโครงสร้างเหมือน
การเรียงตัวของ C ต่าง แบ่งเป็น
-Enantiomer
(เป็นเงาซึ่งกันและกัน แต่เงาไม่ทับกัน)
-Diasteriomer
(ไม่เป็นเงาซึ่งกันและกัน)
ประเภทของสารประกอบคาร์บอน
1. ลักษณะของการเกิดปฏิกิริยาเป็นเกณฑ์
- Saturated Hydrocarbon (อิ่มตัว) เป็นพันธะเดี่ยวทั้งหมด
- Unsaturated Hydrocarbon (ไม่อิ่มตัว) มีพันธะ
อย่างน้อย 1 พันธะ
2. ใช้โครงสร้างเป็นเกณฑ์
-Aliphatic Hydrocarbon (โซ่เปิด)
-
Straight Chain Structure (โซ่ตรง)
- Branch
Chain Structure (โซ่กิ่ง)
-Alicyclic Hydrocarbon (โซ่ปิด) C ทุกตัวในวงมีค่าเท่ากัน เมื่อไม่มีหมู่ฟังก์ชันเกาะ
-Aromatic Hydrocarbon (โซ่ปิดพิเศษ) เสถียรสุดๆ เพราะ เกิดเรโซแนนซ์ได้
จากสมการ จำนวน(e-
= 4n+2
หาก
n
I+
สรุปว่า วง C
ที่เป็นโซ่ปิดนี้ เป็น Aromatic
-Heterocyclic (ในวงมีอย่างน้อย
1 มุม ที่ไม่ใช่ C)
3. ใช้หมู่ฟังก์ชันเป็นเกณฑ์
หมู่ฟังก์ชันใช้ในการเรียกชื่อและจัดหมู่สารอินทรีย์
 |
| หมู่ฟังชันเรียงตามความสำคัญ |
Organic Reaction มี 6 ประเภท ได้แก่
1.ปฏิกิริยาการแทนที่ (Substitution
Reaction) พบเฉพาะสารประกอบยคาร์บอนที่อิ่มตัวแล้ว
2.ปฏิกิริยาการเติม (Addition
Reaction) พบในสารประกอยคาร์บอนที่ไม่อิ่มตัว เช่น Alkene, Alkyne
3.ปฏิกิริยาการขจัดออก (Elimination
Reaction) การดึงเอาอะตอมใดๆออกจากโมเลกุล
4.ปฏิกิริยาการจัดเรียงตัวใหม่ (Rearrangement
Reaction) การจัดเรียงตัวใหม่ในสภาวะที่เหมาะสม
แต่สูตรโมเลกุลเหมือนเดิม
5.ปฏิกิริยาพอลิเมอไรเซชัน (Polymerization
Reaction) ทำให้สารประกอบ C มีโมเลกุลใหญ่ขึ้นโดยมีหมู่ซ้ำกัน
6.ปฏิกิริยาการแตกตัว (Cracking
Reaction) การแตกตัวให้สารประกอบ C จากโมเลกุลใหญ่เป็นโมเลกุลเล็ก
การสร้างพันธะและการทำลายพันธะ(Bond
Forming and Bond Cleavage)
การสร้างพันธะ
1.สร้างพันธะแบบเสมอภาค(Homolytic
Forming) พันธะระหว่าง 2 อะตอม ใช้ e- อะตอมละ 1 ตัวร่วมกัน เกิด พันธะโคเวเลนต์ 1พันธะ
2.สร้างพันธะแบบไม่เสมอภาค(Heterolytic
Forming) พันธะระหว่าง 2 อะตอม โดยอะตอมหนึ่งให้ e- 2 ตัวกับอีกอะตอมหนึ่งที่มีออร์ยิทอลว่าง เกิด พันธะโคเวเลนต์ 1พันธะ
การสลายพันธะ
1.สลายพันธะแบบเสมอภาค(Homolytic
Cleavage) คืน e- กลับไปที่อะตอม
อะตอมละ 1 ตัว เกิด อนุมูลอิสระ (Free Radical)
2.สลายพันธะแบบไม่เสมอภาค(Heterolytic
Cleavage) การแตกพันธะโดยอะตอมที่ใช้ e- ร่วมกันอะตอมใดอะตอมหนึ่งดึง e- ไปทั้งคู่
เกิด อนุมูลประจุบวก (Cation) และอนุมูลประจุลบ
(Anion) ขึ้นอยู่กับ
EN เรียกว่าปฏิกิริยาไอออนิก
คาบเรียนที่ 3 วันอังคารที่ 9 พ.ย. 2553
"สารมัธยันตร์-การเหนี่ยวนำ-เรโซแนนซ์ กับ การเรียกชื่อ Alkane แสนสนุก"
สารมัธยันตร์(Intermediate)
สารมัธยันตร์ที่พบในเคมีอินทรีย์ของคาร์บอนจำแนกได้ 4 แบบ
1. Carbon Radical
 |
| ความเสถียรของ Carbon Radical |
2. Carbocation / Carbonium ion
 |
| ความเสถียรของ Carbocation |
3. Carboanion / Carbanion
 |
| ความเสถียรของ Carboanion |
4. Carbene
ผลที่เกิดจากการเหนี่ยวนำ (Inductive
Effect)
การเหนี่ยวนำความหนาแน่นของ e-
ของอะตอมหรือหมู่อะตอมผ่านพันธะเดี่ยวจะส่งผลต่อ
1.ความมีขั้ว
2.ความว่องไวของ Reaction
3.ความเสถียรของ Intermediate
4. ความเป็นกรดและเบส
 |
| ความเป็นกรด |
 |
| ความเป็นเบส |
การแบ่งหมู่ที่มีผลต่อการเหนี่ยวนำ
A. หมู่ที่ให้
e-
(Electron donating group)
- หมู่อัลคิล
- หมู่ที่มี
O
หรือ N เป็นประจุลบ
B. หมู่ที่ดึง
e-
(Electron withdrawing group)
- หมู่ฮาโลเจน
- หมู่อะมิโน
- หมู่ไฮดรอกซิล
- หมู่คาร์บอนิล
- หมู่ไนโทร
- หมู่แอมโมเนียม
- หมู่ฟีนิล
การเกิดปรากฏการณ์เรโซแนนซ์ (Resonance
Effect)
เรโซแนนซ์ คือ การที่
e- หรือ e- คู่โดดเดี่ยวเคลื่อนที่ผ่านพันธะไพ
เรียกการเคลื่อนที่ของ e- ว่า ดีโลคาไลเซชัน (Delocalisation) การเกิดเรโซแนนซ์จะทำให้โมเลกุลมีระดับพลังงานต่ำลงและเสถียรมากขึ้น
อัลเคน เป็นสารประกอบไฮโดรคาร์บอน
บางแห่งจะเรียกสารประกอบอัลเคนว่า Paraffins มาจากภาษาละติน
แปลว่า ว่องไวต่ำ
การเรียกชื่อ มีได้ 2 แบบ
1. ชื่อสามัญ
(Common
Name)
ส่วนใหญ่จะใช้เรียกสารที่มีโครงสร้างไม่ซับซ้อน
โดยจะมีคำอุปสรรค(Prefixes) นำหน้าเพื่อบอกจำนวน C
ในแต่ละโมเลกุล
ตัวอย่างการเรียกชื่อสามัญ
หมู่อัลคิล (Alkyl
Group)
หมู่อัลคิล
เป็นส่วนของโมเลกุลสารประกอบไฮโดรคาร์บอนประเภทอัลเคนที่ถูกดึง H ออก 1 อะตอม หากหมู่อัลคิลมี C ตั้งแต่ 3
อะตอมขึ้นไปจะมีโครงสร้างได้มากกว่า 1 แบบ ดังนั้นจึงต้องมีข้อตกลงในการเรียกชื่อหมู่อัลคิล
ข้อตกลง
- n- ย่อมาจาก normal ใช้กับหมู่อัลคิลที่เป็นโซ่ตรง
- iso-
ใช้กับหมู่อัลคิลที่ มีmethyl เป็นกิ่งที่ C
ตัวรองสุดท้าย และตำแหน่งถัดไปคือ ปลายสุดของสาย
- sec-
ย่อจากคำว่า secondary เรียกหมู่อัลคิลที่มีจุดต่อตรง
C ทุติยภูมิ(Secondary Carbon)
- tert-
ย่อจากคำว่า tertiary เรียกหมู่อัลคิลที่มีจุดต่อตรง
C ตติยภูมิ(Tertiary Carbon)
- neo-
ใช้กับหมู่อัลคิลที่ มีmethyl เป็นกิ่งมาเกาะล้อมรอบทั้ง
4 แขน
ตัวอย่างหมู่อัลคิล
2. ชื่อ
IUPAC
(International Union of Pure and Applied Chemistry)
มีหลักเกณฑ์ ดังนี้
1. หา
C
ที่ยาวที่สุดเป็นโซ่หลัก แล้วพิจารณาส่วนที่เหลือ คือ หมู่อัลคิล
2. ให้ตำแหน่งโซ่หลักโดยเริ่มต้นจากด้านที่ให้หมู่อัลคิลมาเกาะอยู่เป็นตัวเลขน้อยๆ
3. ถ้าเลือกโซ่หลักได้มากกว่า
1 ทาง ให้เลือกทางที่มีหมู่อัลคิลเกาะมากที่สุด
4. กรณีที่หมู่อัลคิลอยู่ห่างจากปลายโซ่หลักทั้ง
2 ข้างเท่ากันให้เลือกทางที่ผลรวมตัวเลขตำแหน่งน่อยที่สุด(นับทางที่หมู่เกาะเยอะมาก่อน)
5. บอกตำแหน่งที่หมู่อัลคิลมาเกาะแล้วตามด้วยชื่อหมู่อัลคิลใช้
(-) ระหว่างตัวเลขกับตัวอักษร
6. เมื่อมีหมู่อัลคิลชนิดเดียวกันมาเกาะที่โซ่หลัก
ให้บอกทุกตำแหน่งที่มีหมู่อัลคิลนั้นมาเกาะ(ถ้าตำแหน่งเดียวกันให้ซ้ำเลขนั้น 2 ครั้ง) ใช้(,)
คั่นระหว่างตัวเลขด้วยกันแล้วตามด้วยคำนำหน้าหมู่อัลคิลตามจำนวนที่เหมือนกัน เช่น di,tri,tetra
7. เมื่อมีหมู่อัลคิลหลายหมู่มาเกาะให้นับเรียงอักษรภาษาอังกฤษโดย
- mono,di,tri,tetraไม่นับเรียงอักษร
- sec-,tert-,n-
ไม่นับเรียงอักษร
- iso,neo-,cyclo
นับเรียงอักษร
- โซ่หลักอยู่ท้ายสุด
8. ถ้ามีหมู่ฟังก์มาเกาะด้วยให้นับเรียงความสำคัญก่อน
แล้วค่อยเรียงตัวอักษรภายในความสำคัญเท่ากันอีกที(ความสำคัญเรียงจากซ้ายไปขวา
น้อยไปหามาก) ส่วนโซ่หลักยังอ่านชื่อท้ายสุดเหมือนเดิม
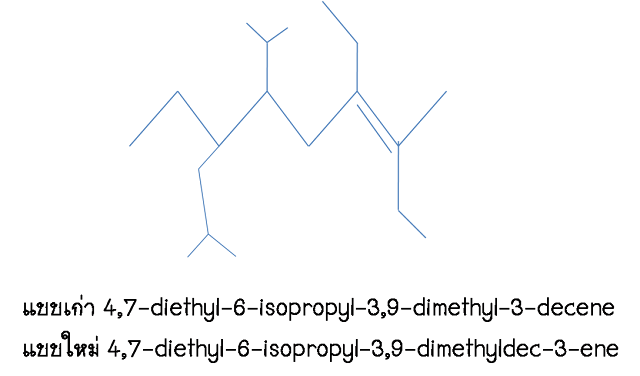
ตัวอย่างการเรียกชื่อ
คาบเรียนที่ 4 วันศุกร์ที่ 12 พ.ย. 2553
" Alkane
Part II"
สมบัติทางกายภาพ (Physical
Properties)
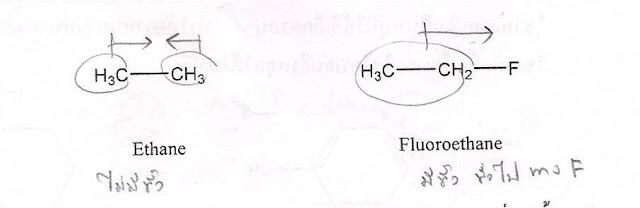
- อัลเคนเป็นโมเลกุลไม่ขั้ว
ดังนั้น แรงยึดเหนี่ยวระหว่างโมเลกุลอ่อนมาก
- ที่อุณหภูมิห้องความดัน
1 บรรยากาศ
จุดเดือดและจุดหลอมเหลว
จุดเดือดจะเพิ่มขึ้นตามจำนวน C ที่เพิ่มขึ้น กล่าวคือ nC
Bp
ความหนาแน่น
อัลเคนเป็นสารที่มีความหนาแน่นน้อยที่สุดในจำพวกโมเลกุลสารอินทรีย์
อัลเคนทุกตัวมีความหนาแน่น
ทำให้อัลเคนลอยน้ำ
การละลาย
สารประกอบอัลเคนไม่ละลายน้ำเพราะไม่มีขั้ว
อัลเครที่เป็นของเหลวจะละลายเข้ากัน ส่วนตัวทำละลายส่วนมากจะใช้ Benzene, CCl4เป็นต้น
การเตรียมสารประกอบอัลเคน
(Synthesis of Alkanes)
1.
Hydrogenation of
Alkenes or Alkynes
เป็นการเตรียมอัลเคน
โดยการเติม H เข้าไปในพันธะไพของอัลคีนหรืออัลไคน์
โดยมีโลหะเป็นตัวเร่งปฏิกิริยา
2.
Hydrogenation of
alkyhalides
เป็นการเตรียมอัลเคน
โดยให้ H เข้าไปทำปฏิกิริยากับอัลคิลเฮไลด์ โดยมีโลหะเป็นตัวเร่งปฏิกิริยา
ปฏิกิริยาของสารประกอบอัลเคน
(Reaction of Alkanes)
อัลเคนเป็นสารประกอบที่อิ่มตัวแล้ว
จึงไม่ค่อยมีปฏิกิริยากับสารอื่น ปฏิกิริยาที่พบได้แก่
1.
Halogenation of
Alkanes (ปฏิกิริยาฟอกจางสีBr)
เป็นปฏิกิริยาการแทนที่
H ในอัลเคนด้วยฮาโลเจน
จนเกิดเป็นอัลคิลเฮไลด์ โดยมีแสงหรือความร้อนเป็นตัวเร่งปฏิกิริยา
2.
Combustion Reaction (ระเบิดด้วย O2
,เผาไหม้ ,สันดาป)
การเผาไหม้มี 2
แบบ
- สมบูรณ์ (O2 เพียงพอ)
- ไม่สมบูรณ์(O2 ไม่เพียงพอ)
สารประกอบไซโคลอัลเคน
การเรียกชื่อ -ใช้หลักเกณฑ์เดียวกับโซ่ตรงแต่ต้องมีคำว่า
Cyclo นำหน้าโซ่หลัก (หากมีโซ่ตรงยาวกว่าโซ่ปิด
โซ่ปิดจะกลายเป็นกิ่ง) ส่วนการนับกิ่งถ้ามีเพียงกิ่งเดียว ไม่ต้องมีเลข 1 หน้าหมู่อัลคิลเพราะจะเป็นที่รู้ว่ากันว่าเป็นตำแหน่งที่
1
ตัวอย่างการเรียกชื่อ
ปฏิกิริยาของสารประกอบไซโคลอัลเคน
(Reaction of Cycloalkanes)
- มีปฏิกิริยา hydrogenation
เหมือน alkanes
- ในวงเล็กๆ อาจเกิดการแตกวงได้
คาบเรียนที่ 5
วันอังคารที่ 16 พ.ย. 2553 "Alkenes"
เพิมเติม Alkene คาบเรียนที่ 5
วันศุกร์ ที่ 26 พ.ย. 2553 (By อ.ไพรินทร์)
สารประกอบอัลคีน (Alkenes)
อัลคีนเป็นสารประกอบไฮโดรคาร์บอนที่มพันธะไพ
1แห่ง บางแห่งจะเรียกสารประกอบอัลเคนว่า Olefins มาจากภาษาละติน
แปลว่า แหล่งน้ำมัน
สูตรทั่วไปของอัลคีน
การเรียกชื่อ
- ชื่อสามัญ
เหมือน alkanes
เพียงเปลี่ยนคำลงท้ายจาก –anes เป็น –ylenes
ตัวอย่างการเรียกชื่อสามัญ
- ชื่อ
IUPAC
เหมือน alkanes เปลี่ยนคำลงท้ายจาก–anes
เป็น –enes และกำหนดว่าโซ่หลักจะต้องเป็นโซ่ที่ยาวที่สุด
และ ต้องมีพันธะคู่ปรากฏอยู่ในโซ่หลัก โดยนับจากทางที่พันธะคู่มีตำแหน่งน้อยที่สุด
ตัวอย่างการเรียกชื่อแบบ IUPAC
ทั้งแบบเก่าและแบบใหม่
- หมู่อัลคิล
ที่พบบ่อยจะมีชื่อเรียกเฉพาะ คือ Vinyl กับ Allyl
การแทนที่ H ด้วยหมู่
Alkyl 2 หมู่ (Disubtituted)
การแทนที่ลักษณะนี้จะมองในรูปแบบของสารประกอบที่เป็นอนุพันธ์ของ
Ethylene
ซ่งจะก่อให้เกิดไอโซเมอร์เชิงเรขาคณิต (Geometrical Isomer) โดยมีชื่อเรียกคือ cis- กับ trans-
การเรียกชื่อ
สมบัติทางกายภาพ
- โดยทั่วไปเหมือนอัลเคน
- จุดเดือด
Alkanes
Alkenes
เพราะ มวลของ Alkanes มากกว่า
- อัลคีนที่มี
C
น้อยกว่า 5 อะตอม จะระเหยได้ดีที่อุณหภูมิห้อง
1. Dehydrohalogenation
of Alkylhalides by alc. KOH
2. Dehydration
of Alcohols
เตรียมโดยให้ความร้อนกับแอลกอฮอล์ด้วยกรดแก่
ทำให้แอลกอฮอล์สูญเสียโมเลกุลของน้ำ โครงสร้างจะเกิดพันธะไพขึ้น
3. Reduction
of Alkynes
เป็นการเติม H ลงไปมรโมเลกุลของสารประกอบอัลไคน์
เหมือกับการเตรียมอัลเคนแต่ตัวใช้ตัวเร่งปฏิกิริยาบางชนิดเพื่อหยุดการเติม H
ให้เป็นเพียงอัลคีนเท่านั้น ไม่เช่นนั้นจะถูกเติมต่อจนกลายเป็นอัลเคน
Reagents: 1.Na/Li
ใน Liq NH3 ได้ผลิตภัณฑ์เป็น trans-
ปฏิกิริยาของสารประกอบอัลคีน (Reaction
of Alkenes)
1.
Addition Reaction
of Alkenes
เป็นการเติม H หรือ Halogen
ทำให้พันธะไพแตกออกเป็นพันธะซิกมา ได้แก่
- Halogenation of Alkenes
อะตอมของธาตุฮาโลเจนถูกเติมลงในอัลคีน
ทำให้อัลแตกพันธะคู่มาจับกับธาตุฮาโลเจน
- Hydrogenation Of Alkenens
ทำนองเดียวกับ Halogenation แต่การเติม H ในโมเลกุลของอัลคีน ไม่ต้องใช้ความร้อนเป็น Catylyst
- Hydrohalogination of Alkenes (Markovnikov’s
rule)
เป็นการเติม
อัลคิลเฮไลด์ลงในอัลคีน H จะเข้าที่ตำแหน่งคาร์บอนที่มีอะตอม H มากที่สุด
- Hydration of Alkenes = Dehydration of Alcohol
เติมน้ำลงในโมเลกุลของอัลคีน
ใช้กรดเป็นตัวเร่ง ได้ผลิตภัณฑ์เป็น แอลกอฮอล์
2.
Hydroxylaion of
Alkenes (ปฏิกิริยาฟอกจาสีด่างทับทิม)
เติม Hydroxyl
ลงในอัลคีนได้ glycol เป็นผลิตภัณฑ์ ใช้ KMnO4 ในสารละลายเบสเป็นรีเอเจนต์
3.
Ozonolysis of
Alkenes
ใช้ O3 เพื่อตัดโครงสร้างของอัลคีนให้กลายเป็นอัลดีไฮด์ หรือ
คีโตน
4.
Polymerization
เป็น Reactionในสภาวะที่เหมาะสมระหว่างอัลคีนด้วยกัน
ทำให้กลายเป็นสารประกอบโมเลกุลใหญ่ ถ้ามีอัลคีนมาเกินพอจะเกิด พอลิเมอร์
คาบเรียนที่ 6 วันอังคารที่ 21 ธ.ค. 2553 "Alkynes"
สารประกอบอัลไคน์(Alkynes)
การเรียกชื่อ
สมบัติทางกายภาพ
ถ้า C เท่ากัน
Bp จะเรียงลำดับได้ดังนี้
Alkynes > Alkanes >
Alkenes
เพราะความแตกต่างของความหนาแน่น
e- ระหว่าง C
ด้านที่มีพันธะสามกับด้านที่เป็นพันธะ
บทอื่นๆที่เหลือ Aromatic-Amine
เว็บไซต์ที่เกี่ยวข้อง
http://e-book.ram.edu/e-book/inside/html/dlbook.asp?code=CH221
http://dl.clackamas.cc.or.us/ch106-01/iupac.htm
ขอบคุณครับ by SK
เดี่ยวมีความแตกต่างกันมากจนเกิดสภาพคล้ายการมีขั้ว
การเตรียมสารประกอบอัลไคน์
(Synthesis of Alkynes)
1.
การเตรียมอะเซทีลีนจากแคลเซียมคาร์ไบด์(CaC2)
2.
เตรียมอัลไคน์ด้วยปฏิกิริยากำจัดออก
เตรียมได้จาก geminal dihalides หรือ
vicinal dihalides
3.
เตรียมอัลไคน์จากสารประกอบเตตระฮาโลเจน
ใช้สารประกอบเตตระฮาโลเจนทำปฏิกิริยากับสังกะสี
สังกะสีจะกำจัดฮาโลเจนออกหมด และเกิดเป็นพันธะสาม
ปฏิกิริยาของอัลไคน์
(Reactions of Alkynes)
1.
Hydrogenation of
Alkynes
เติม H โดยใช้โลหะเป็นตัวเร่งปฏิกิริยา
2.
Synthesis of
Alkenes
เติม H โดยใช้โลหะ Pd เป็นตัวเร่งปฏิกิริยาโดยมี
BaSo4 or CaCO3 ฉาบอยู่
3.
Halogenation of
Alkynes
เติมฮาโลเจนลงไปในสารประกอบอัลไคน์จะได้ผลิตภัณฑ์เป็นสารประกอบเตตระฮาโลเจน
โดยไม่ต้องใช้แสงเป็นตัวเร่ง
4.
Hydrohalogenation
of Alkynes
5.
Hydration of
Alkynes
6.
Oxidation
Reaction
สารประกอบอัลไคน์สามารถเกิดปฏิกิริยาได้ง่าย
ตัวออกซิไดส์ที่ใช้คือสารละลายด่างทับทิมในเบสร้อน จะได้เกลือของกรดอินทรีย์(Carboxylate ion)
ซึ่งสามารถเปลี่ยนเป็นกรดอินทรีย์ได้โดยการเติมกรดเจือจางลงไป ถ้าหากเป็น terminal alkynes จะได้แก๊ส
CO2 ด้วย
7.
Polymerization of
Acetylene
อะเซทิลีนทำปฏิกิริยาในหลอดร้อนทำให้ได้ผลิตภัณฑ์ที่เป็นวงเกิดขึ้น
คาบเรียนที่ 7
วันอังคารที่ 4 ม.ค. 2554 "Dienes"
Alkadienes เป็นสารประกอบอัลคีนที่มีพันธะคู่สองตำแหน่งในสายโซ่โมเลกุล
ดังนั้นคุณสมบัติจึงเหมือนกับอัลคีน แต่ไดอีนบางชนิดมีคุณสมบัติต่างออกไป
ชนิดของอัลคาไดอีน
การเรียกชื่อ
ตามระบบIUPAC
เรียกเหมือนอัลคีน เพียงแต่ลงว่า Diene
และระบุเลข 2
ตัวไว้หน้าชื่อเพื่อระบุตำแหน่งของพันธะคู่ทั้ง 2
การเตรียมสารประกอบอัลคาไดอีน
1. Dehydration of Diols (glycol)
เตรียมไดอีนโดยการต้มกับกรดซัลฟิวริก
ทำให้ –OH
หลุดออกแล้วกลายเป็นพันธะคู่
2. Dehydrohalogenation of isolated dihalides
ขจัดฮาโลเจนกับไฮโดรเจนออกจากโมเลกุลของ
isolated dihalides โดยใช้ alc.
KOH
ไม่ใช้ germinal หรือ vicinal dihalides เพราะจะเกิดเป็นอัลไคน์
ปฏิกิริยา Polymerization
เว็บไซต์ที่เกี่ยวข้อง
http://e-book.ram.edu/e-book/inside/html/dlbook.asp?code=CH221
http://dl.clackamas.cc.or.us/ch106-01/iupac.htm
ขอบคุณครับ by SK























































































ไม่มีความคิดเห็น:
แสดงความคิดเห็น